Se le denomina partícula a un cuerpo dotado de
masa,
y del que se hace abstracción del tamaño y de la forma.
Una partícula subatómica es una partícula
mas pequeña que un
átomo, puede ser elemental o compuesta.
A
principios del siglo XX, se realizo el
descubrimiento de unas partículas subatómicas
llamadas protón, electrón y neutron, estas están contenidas en el átomo.
Tal vez
uno pueda preguntarse si estas partículas tan pequeñas pueden
tener estructura; es interesarse darse cuenta de que si tienen estructura.
Para
poder definir una partícula subatómica es necesario
conocer las características de estas, las cuales describiremos a continuación.
Carga: La carga es una magnitud escalar (Solo se puede determinar su cantidad).
Spin: Movimiento de rotación
sobre un eje imaginario.
Los científicos han desarrollado una
teoría llamada El
modelo Estándar que explica las diferentes moléculas y sus complejas interacciones con solo:
6 Quarks
6 Leptones
Las partículas subatómicas de las cuales se sabe su existencia son:
- Bosón
- Positrón
- Electrón
- Protón
- Fermión
- Neutrino
- Hadrón
- Neutrón
- Leptón
- Quark
- Mesón
Las partículas están formadas
por componentes atómicos como los electrones, protones y neutrones, (los protones y los neutrones son partículas compuestas), estas están formadas de quarks. Los Quarks se mantienen
unidos por las partículas gluon que provocan una
interacción en los quarks y son indirectamente responsables por mantener los protones y neutrones
juntos en el núcleo atómico.
Bosón
El bosón es una partícula atómica o subatómica, de
spin entero o nulo, que
cumple los postulados de la
estadística de Bose-Einstein e incumple el principio de exclusión de Paulli (establece que
dos electrones no pueden ocupar el mismo
estado energético). Son bosones las partículas alfa, los fotones y los nucleidos con un
número par de nucleones.
El bosón recibe su
nombre por Satyendra Nath Bose, un
científico Bengali responsable de su descubrimiento. Debido a su spin, los bosones siguen la estadística Bose-Einstein, en
donde cualquier número de bosones puede compartir el mismo
estado cuantico. Los bosones no son realmente resistentes si se ubican en el mismo
lugar, estos mismos, tienen momentos intrínsecos angulares, en
unidades integrales de h/ (2
El hecho de que los bosones puedan ocupar un estado cuantico les permite comportarse de manera colectiva, y son responsables por el
comportamiento de los lásers y el helio superfluito.
Fermión
Es una partícula perteneciente a una familia de partículas elementales caracterizada por su momento angular intrínseco o spin. Los fermiones son nombrados después de Enrico Fermi, en el modelo estándar, existen dos tipos de fermiones elementales, que son: Los quarks y los leptones. Según la teoría cuantica, el momento angular de las partículas solo puede adoptar determinados valores, que pueden ser múltiplos enteros de una determinada constante h (Constante de Planck) o múltiplos semientereos de esa misma constante. Los fermiones, entre los que se encuentran los electrones, los protones y los neutrones, tienen múltiplos semienteros de h, por ejemplo ±1/2h o ±3/2h. Los fermiones cumplen el principio de exclusión. El nucleo de un átomo es un fermion o boson, dependiendo de si el número total de sus protones y neutrones es par o impar respectivamente. Recientemente, los científicos han descubierto que esto causa comportamiento muy extraño en ciertos átomos cuando son sometidos a condiciones inusuales, tal como el helio demasiado frió.
Quarks
El
nombre genérico con que se designan los constituyentes de los hadrones. La
teoría sobre los quarks se inicio a partir de los
trabajos de Gell-Mann
y Zweig (1966) y su existencia fue confirmada en 1977 (Por Fairbank y otros).
La
física dedicada al
estudio de la
naturaleza fundamental de la
materia ha formulado un
modelo estándar, capaz de explicar una
serie de hechos e incapaz de
dar respuesta a otros. Este
modelo se basa en la
actualidad en la
hipótesis de que la
materia ordinaria esta formada
por dos clases de partículas, los quarks (que se combinan
para formar partículas mayores) y los leptones, además de que las fuerzas que actúan
entre ellas se transmiten mediante una tercera
clase de partículas
llamadas bosones, que ya explicamos anteriormente. El
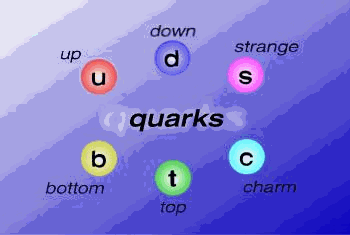
spin de los quarks es de ½, hay seis
tipos distintos de quarks que los físicos han denominado de la siguiente manera: up, down, charm, strange,
top, y bottom además de los correspondientes antiquarks.
La carga eléctrica de los quarks es fraccionaria de la
unidad fundamental de carga; así por ejemplo, el quark up tiene una carga fraccionaria
igual a 2/3 de la unidad elemental.
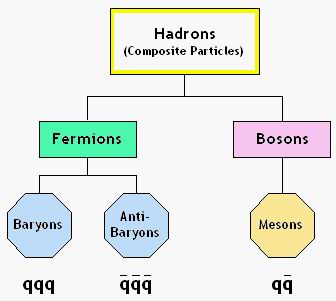
Los quarks no se encuentran
libres en la naturaleza sino formando hadrones, estos se dividen en dos tipos:
mesones: Formados por un quark y un antiquark
bariones: Formados por
tres quarks
Además de las cargas ya mencionadas, los quarks tienen otra carga de
color, que no tiene nada que
ver con el
color real de estas partículas, y que mantiene
unidos a los quarks mediante la
interacción fuerte, además de ser la responsable de la formación de estos hadrones. Esta interacción esta descrita por la cromo
dinámica cuantica (QCD). Existen tres tipos de carga de color:
roja, azul y
verde. Los antiquarks presentan además cargas opuestas, antirroja, antiazul, y antiverde. Los quarks están unidos entre si mediante el intercambio de partículas virtuales mediadoras de la interacción fuerte: los gluones. Junto a los leptones, los quarks forman prácticamente toda la materia de la que estamos rodeados. El termino quark, fue propuesto por Murria Gell-Mann, sacado de una
novela de James Joyce, Finegan’s wake, del verso Three Quarks for Mr. Mark.
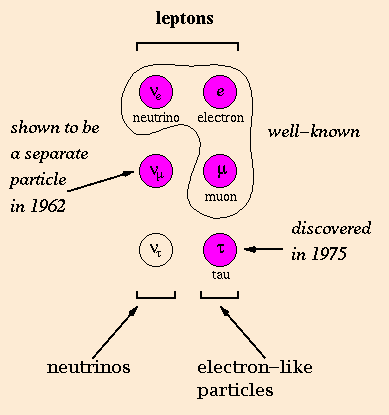
Leptón
Nombre que recibe cada una de las partículas elementales de spin igual a +1/2 y
masa inferior a la de los mesones. Los leptones son fermiones entre los que se establecen interacciones débiles, y
solo interacciones electromagnéticas si poseen carga eléctrica. Además, los leptones con carga eléctrica se encuentran
casi siempre unidos a un neutrino asociado.
Existen tres tipos de leptones: el electrón, el muon y el tau. Cada
uno esta representado por un
par de partículas. Una es una partícula masivamente cargada, que lleva el mismo nombre que su partícula, (Como el electrón). La otra es una partícula neutral casi
sin masa
llamada neutrino (tal como el electrón neutrino). Todas estas 6 partículas tienen antipartículas correspondientes (tales como el positrón o el electrón antineutrino). Todo los leptones cargados tienen una
sola unidad de
energía positiva o negativa (de acuerdo a si son partículas o antipartículas) y todos los neutrinos y antineutrinos tienen cero carga eléctrica. Los leptones cargados tienen 2 posibles giros de spin mientras que una sola helicidad es observada para los neutrinos (Todos los neutrinos son zurdos y los antineutrinos diestros). Los leptones obedecen a una simple relación conocida como la formula Koide. Cuando las partículas interactúan, generalmente el
numero de leptones del
mimo tipo (electrones y electrones neutrinos, muones y muones neutrinos, leptones tau y tau neutrinos) se mantienen igual. Este principio es
conocido como la conservación del numero lepton.
El hadron es una partícula subatómica compuesta de quarks, caracterizada por relacionarse mediante interacciones fuertes. Aunque pueden
manifestar también interacciones débiles y electromagnéticas, en los hadrones predominan las interacciones fuertes, que son las que mantienen la cohesión interna en el núcleo atómico. Estas partículas presentan dos categorías: los bariones formados por tres quarks, como el neutron y el protón y los mesones, formados por un quark y un antiquark, como el pion.
La mayoría de los hadrones pueden ser clasificados con el modelo quark que
implica que todos los números cuanticos de bariones son derivados de aquellos de
valencia quark.
Neutrino
Partícula nuclear elemental eléctricamente neutra y de masa
muy inferior a la del electrón (posiblemente nula). El neutrino es un fermión; su espín es 1/2. Antes del
descubrimiento del neutrino, parecía que en la
emisión de electrones de la desintegración beta no se conservaban la energía, el
momento y el espín totales del
proceso. Para explicar esa incoherencia, el
físico austriaco Wolfgang Pauli dedujo las
propiedades del neutrino en 1931.
Al no
tener carga y poseer una masa despreciable, el neutrino es extremadamente difícil de
detectar; las
investigaciones confirmaron sus peculiares propiedades a partir de la medida del retroceso que provoca en otras partículas. Billones de neutrinos atraviesan
la Tierra cada
segundo, y sólo una minúscula proporción de los mismos interacciona con alguna otra partícula. Los físicos estadounidenses Frederick Reines y Clyde Lorrain Cowan, hijo, obtuvieron
pruebas concluyentes de su existencia en 1956.
La antipartícula del neutrino es emitida en los
procesos de desintegración beta que producen electrones, mientras que los neutrinos se emiten junto con positrones en otras reacciones de desintegración beta. Algunos físicos conjeturan que en una extraña forma de radiactividad, llamada
doble desintegración beta, dos neutrinos pueden, en ocasiones, fusionarse para formar una partícula a la que denominan "mayorón". Otro tipo de neutrino de
alta energía, llamado neutrino muónico, es emitido junto con un muón
cuando se desintegra un pión. Cuando un pión se desintegra,
debe emitirse una partícula neutra en sentido opuesto al del muón para conservar el momento. La suposición inicial
era que esa partícula era el mismo neutrino que conserva el momento en la desintegración beta. En 1962, sin embargo, las
investigaciones demostraron que el neutrino que acompaña la desintegración de piones es de tipo diferente. También existe un tercer tipo de neutrino, el neutrino tau (y su antipartícula).
Actualmente, la posibilidad de que los neutrinos puedan oscilar entre una forma y otra resulta de gran
interés. Hasta
ahora, las pruebas en ese sentido son indirectas, pero de confirmarse sugerirían que el neutrino tiene una cierta masa, lo que tendría implicaciones profundas para la cosmología y la física en general: esta masa adicional en
el universo podría suponer que el
universo no siga expandiéndose indefinidamente sino que acabe por contraerse. Aunque existen distintas
interpretaciones, algunos científicos consideran que la
información sobre neutrinos obtenida de la supernova SN 1987A apoya la idea de que el neutrino tiene masa.
Mesón
Nombre que recibe cada una de las partículas elementales sometidas a interacciones fuertes, de espín nulo o entero y carga bariónica nula.
Los mesones, identificados por Powell en 1947 en los rayos cósmicos y cuya existencia había sido postulada por Yukawa en 1935, son partículas inestables, de masa generalmente comprendida entre la de los electrones y la de los neutrones. Los
más estables, cuya
vida media es del orden de la cienmillonésima de segundo, son los piones y los kaones.